La prueba de vitalidad espermática sirve para determinar el porcentaje de espermatozoides vivos en un eyaculado, permitiendo discernir entre espermatozoides vivos no móviles y espermatozoides muertos.
Puede determinarse de forma rutinaria en todos los eyaculados, pero no es necesario cuando al menos el 40% de los espermatozoides son móviles. La presencia de una gran proporción de células vivas pero inmóviles puede ser indicativa de defectos estructurales en el flagelo, por el contrario, un alto porcentaje de células inmóviles y muertas puede indicar una patología epididimaria o una reacción inmunológica debida a una infección. En la evaluación, el porcentaje de células muertas no debe ser mayor al de espermatozoides inmóviles.
La vitalidad espermática debe evaluarse lo antes posible después de la licuefacción de la muestra de semen, preferiblemente a los 30 minutos, pero en cualquier caso, dentro de la hora siguiente a la eyaculación, para limitar los efectos nocivos de la deshidratación o los cambios de temperatura sobre la vitalidad.
A pesar de que en el último manual de la OMS sobre procesamiento y evaluación de muestras de semen se ha eliminado la nomenclatura en el diagnóstico de espermiograma, anteriormente a las muestras con menos del 54% de espermatozoides vivos se les denominaba como necrozoospermia. Esta nomenclatura aún se sigue utilizando en muchas unidades de reproducción.
El cálculo del porcentaje de espermatozoides vivos se basa en la identificación de los que tienen una membrana celular intacta, por exclusión de colorantes o por hinchazón hipotónica.
La prueba recomendada por la OMS para el diagnóstico es la prueba de eosina-nigrosina (exclusión de colorantes), pero también existen otras que iremos detallando a continuación para determinar la vitalidad espermática:
Tests por exclusión de colorante:
Las células muertas tienen las membranas plasmáticas dañadas, lo que permiten la entrada de colorantes impermeables al interior de la célula pudiendo distinguir un espermatozoide vivo (no se tiñe) de uno muerto (teñido).
1-Prueba de vitalidad con eosina-nigrosina
Esta técnica de tinción en un solo paso utiliza la nigrosina para aumentar el contraste entre el fondo y las cabezas de los espermatozoides, lo que hace que sean más fáciles de distinguir. Además, permite conservar los portaobjetos para su reevaluación, formación y control de calidad.
Procedimiento:
- Mezclar bien la muestra de semen.
- Extraer una alícuota de 50-μl de semen, mezclar con un volumen igual de suspensión de eosina-nigrosina (por ejemplo, en un pocillo de placa de porcelana o en un tubo de ensayo), y esperar 30 segundos.
- Hacer un frotis en un portaobjetos de vidrio y dejarlo secar al aire.
- Examinar inmediatamente después del secado (con riesgo de contaminación del objetivo con nigrosina), o más tarde después de montar con un medio de montaje permanente no acuoso.
- Examinar el portaobjetos con la óptica de campo claro a ×1000 aumentos y en inmersión en aceite.
- Contar el número de células teñidas (muertas) o no teñidas (vivas) con la ayuda de un contador de laboratorio.
- Evaluar al menos 200 espermatozoides, para lograr un error de muestreo aceptablemente bajo.
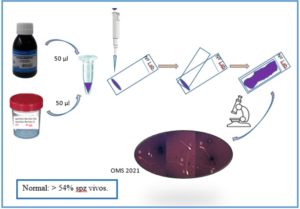
Procedimiento para la realización de test con eosina-nigrosina, elaborado por Ana Fernández.
2-Prueba de vitalidad con eosina
También basado en la desestructuración de la membrana del espermatozoide. Para leer el test tendremos que tener en cuenta que los espermatozoides que están teñidos de color rosa están muertos y los no teñidos, que permanecen con su membrana intacta, están vivos.
Este método es sencillo y rápido, pero las preparaciones húmedas no pueden almacenarse para fines de control de calidad, y se requieren ópticas de contraste de fase negativo para obtener resultados fiables. El contraste de fase positivo, más común, hace que las cabezas rosas débiles sean difíciles de discernir.
Es el método más utilizado en las clínicas de reproducción debido a su sencillez.
Procedimiento:
- Mezclar bien el eyaculado.
- Extraer una alícuota de 5 μl de eyaculado y combinarla con 5 μl de solución de eosina en un portaobjetos. Mezclar con una punta de pipeta, agitando la muestra en el portaobjetos.
- Cubrir inmediatamente con un cubreobjetos de 22 mm × 22 mm y dejarlo durante 30 segundos.
- Examinar el portaobjetos con una óptica de contraste de fase negativa con un aumento de×200 o ×400.
- Contar el número de células teñidas (muertas) y no teñidas (vitales) con la ayuda de un contador de laboratorio.
- Evaluar 200 espermatozoides, para lograr un error de muestreo aceptablemente bajo.
- Calcular la proporción de células vivas.
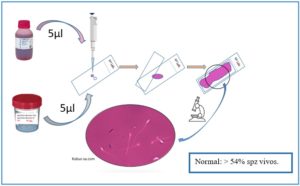
Procedimiento para la realización de test con eosina, elaborado por Ana Fernández.
Si la tinción se limita sólo a una parte de la región del cuello, y el resto de la zona de la cabeza no está teñida, esto se considera una «fuga de la membrana del cuello», y no un signo de muerte celular y desintegración total de la membrana. Estas células deben ser evaluadas como vivas.
Test de vitalidad por hinchazón hipoosmótica (HOS TEST)
Como alternativa a la exclusión del colorante, puede utilizarse la prueba de hinchazón hipoosmótica para evaluar la vitalidad. Esto es útil cuando queremos utilizar los espermatozoides después para alguna técnica como por ejemplo el ICSI. El HOS TEST se basa en la hinchazón del espermatozoide que tiene las membranas intactas al someterlo a una solución hipoosmótica. Los espermatozoides muertos no tiene las membranas intactas por lo que no son capaces de regularse bajo esas condiciones. Los espermatozoides con membranas intactas se hinchan en 5 minutos en medio hipsosmótico, y todas las formas flagelares se estabilizan a los 30 minutos (se recomienda 5 min de incubación cuando vamos a utilizar los espermatozoides en algún tratamiento y 30 min cuando el diagnóstico es de rutina).
Procedimiento:
- Mezclar bien el eyaculado.
- Extraer una alícuota de 100-μl de eyaculado y añadirla a la solución de hinchamiento. Mezclar suavemente metiendo y sacando de la pipeta.
- Incubar a 37 °C durante 5 minutos exactos o 30 minutos (véase más arriba), luego transferir una alícuota de 10-μl a un portaobjetos limpio y cubrir con un cubreobjetos de 22 mm × 22 mm.
- Examinar el portaobjetos con una óptica de contraste de fase con un aumento de ×200 o ×400.
- Contar el número de células no hinchadas (muertas) e hinchadas (vitales) con la ayuda de un contador de laboratorio.
- Evaluar al menos 200 espermatozoides para lograr un error de muestreo aceptablemente bajo.
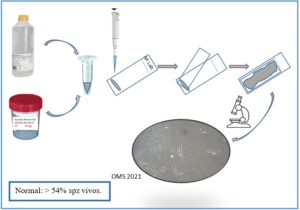
Procedimiento para la realización de test de hinchazón hipoosmótica, elaborado por Ana Fernández.
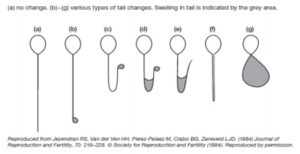
Los espermatozoides hinchados se identifican por los cambios en la forma de la célula, indicados por el enrollamiento de la cola.
Si te ha interesado esta entrada sobre vitalidad espermática, te recomendamos otras sobre análisis del semen:
Bibliografía:
- WHO laboratory manual for the examination and processing of human semen. Sixth Edition. ISBN: 978-92-4-003078-7

Dejar una opinión