En la anterior entrega de esta serie, dejamos al espermatozoide ya en el interior del oocito, pero aún deben darse varios pasos cruciales para que se produzca la fecundación y se acabe por originar un nuevo individuo.
1-Activación del oocito:
Para que se produzca la activación del oocito, es indispensable que se produzca un aumento del calcio intracelular (Ca). En mamíferos, el incremento de esta concentración de Ca se produce en cuestión de minutos, pasando del nivel basal de 50-100 nmol/l a picos de 600-1000 nmol/l. Tras este pico, se producen oscilaciones repetitivas en la concentración del Ca, entre cada 2 a 30 minutos, que se siguen originando hasta la formación de los pronúcleos.
La teoría con más aceptación para explicar cómo el espermatozoide induce las oscilaciones de Ca en el oocito es la siguiente:
El espermatozoide presenta una molécula, factor espermático, que se encarga de activar al oocito. Según varios estudios, este factor espermático, podría ser común desde muy pronto en la evolución, ya que se han conseguido activar oocitos de ratones con extractos solubles de aves y anfibios.
Existen dos candidatos principales para ser reconocidos como el factor espermático:
-PT32: proteína perinuclear de la teca de 32 KDa. Esta proteína no es soluble, pero al inyectarse en oocitos de cerdo, los activa.
-Fosfolipasa CҀ (PLCҀ): proteína de la familia de la fosfolipasa C, con 74 KDa de peso. Es exclusiva de espermatozoides y al interactuar con el oocito, produce oscilaciones idénticas a las observadas durante la fecundación. Esta proteína se ha encontrado también en aves, por lo que indica su pronta aparición en la evolución animal.
Si bien, para que se produzcan las oscilaciones de calcio, se necesita la acción de un segundo mensajero, en este caso, hablamos del inositol 1,4,5-trifosfato (IP3). Este IP3, actúa sobre sus receptores, el IP3-R, que se encuentra en las membranas de las organelas que contienen las reservas de Ca intracelular, como por ejemplo, el retículo endoplasmático, provocando con su unión la liberación del Ca al citoplasma del oocito.
Cuando esta Ca liberado alcanza una concentración crítica, se cierra el canal que permite el paso del Ca, volviéndo este al interior del retículo por la acción de las bombas ATPasas. Así se forma un ciclo en el que las oscilaciones de Ca son continuas.
Una vez activado el oocito, gracias a las oscilaciones de Ca, se produce la descondensación de la cromatina del espermatozoide y el reinicio de la meiosis II oocitoaria. Cabe destacar, que en la mayoría de las especies, el oocito no completa la meiosis hasta que no es fecundado por un espermatozoide.
Este bloqueo en metafase II se produce por la acción del factor promotor de maduración (MPF), formado por dos subunidades; la quinasa p34cdc2 y la ciclina B1 (induce la ruptura de la envoltura nuclear, condensación de cromatina y ensamblaje del huso meiótico en oocito primario). Este MPF, permanece activo durante el segundo bloqueo oocitario, gracias a la acción de factor citosólico, formado por las proteínas MOS.
El aumento del Ca intracelular, origina la degradación de las proteínas MOS, que inactiva el factor citosólico. De esta forma, se facilita la degradación de la ciclina B1, que acaba por inactivar el MPF, permitiendo así el desbloqueo del oocito.
Cabe destacar el papel importante que también juegan otras proteínas, como la proteinquinasa activada por mitógeno (MAP quinasa). Esta proteína evita la reorganización de la envoltura nuclear, manteniendo la cromatina condensada durante la transición de meiosis I a II. MAP quinasa se desactiva poco después que el MPF, permitiendo así la formación de las membranas que rodean a los pronúcleos.
2-Expulsión del segundo corpúsculo polar:
Hasta que no se libera el segundo corpúsculo polar, el oocito sigue siendo diploide. Se produce una citocinesis asimétrica, donde la mayor parte del citoplasma se queda en una sola célula, conteniendo la otra célula, 23 pares de cromátides y un poco de citoplasma.
La formación de la membrana que rodea al corpúsculo, se origina por la inactivación de la MAP quinasa, que como ya se mencionó anteriormente, impide la formación de membranas. También actúa la proteinquinasa dependiente de Ca (PKC), que se activa durante la fecundación, favoreciendo la extrusión del segundo corpúsculo.
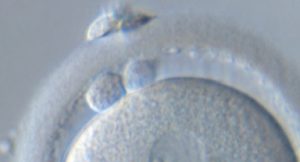
La mecánica de la extrusión de este cuerpo se produce gracias a la acción de los filamentos de actina, que determinan el eje de división celular de la extrusión de los corpúsculos.
3-Descondensación del núcleo espermático en el ooplasma:
El ADN espermático de mamíferos, es el más condensado y compactado de todo el reino animal. Esto se debe, a que las histonas, proteínas que se encargan de compactar el ADN de las células, en el espermatozoide de mamífero es sustituido por protaminas, que son proteínas ricas en arginina, serina y cisteína, que consiguen una mayor compactación.
Además, durante la maduración espermática en el epidídimo, las protaminas sufren cambios moleculares, transformando sus grupos sulfidrilos (-SH) en puentes disulfuro (-S-S-). La formación de estos puentes, brindan al núcleo una dureza excepcional a la ruptura química o mecánica y gracias a esta rigidez, el espermatozoide puede atravesar la zona pelúcida.
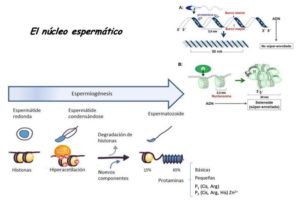
El primer paso en la descondensación del núcleo espermático tras la fecundación, es la ruptura de la envoltura del núcleo. Esto ocurre por la acción de las proteinquinasas C (PKC), que actúan fosforilando a las lamininas que forman la envoltura nuclear.
La duración de la descondensación de la cromatina del espermatozoide es diferente en cada especie, aunque los procesos no son especie-específicos. En la especie humana, la descondensación se ha medido tras realizar ciclos de fecundación in vitro (FIV). Pasados 60 minutos tras la fertilización, se produce una primera descondensación, que es seguida por una recondensación parcial 60 minutos después. Posteriormente, entre los 120-170 minutos tras FIV, se inicia la formación de los pronúcleos.
Para que se produzca esta descondensación, debe actuar el cofactor glutatión reducido, que actúa rompiendo los puentes de disulfuro, debilitando así la estructura de la membrana. Posteriormente, se produce el intercambio de la protaminas por histonas en la cromatina.
Para concluir, destacamos que la activación del oocito no es indispensable para la descondensación del núcleo espermático, pero si lo es para la formación del pronúcleo masculino.
Hasta aquí dejamos la entrada de hoy, no te pierdas la próxima entrega: explicaremos el proceso de formación de los pronúcleos y desarrollo hasta blastocisto:
Bibliografía:
- Langman. Embriología Médica, 13ª ed. Barcelona, España: Ed.Lippincott/Williams & Wilkins, 2016.
- Infertilidad «Fisiología, diagnóstico y tratamiento». Gustavo Pagés ; Juan Aller. 2006.
- The miracle of life. Lennart Nilsson, 1980.
- Cuadernos de embriología clínica. Criterios ASEBIR de Valoración Morfológica de Oocitos, Embriones tempranos y Blastocistos Humanos. 3ª ed. 2015.

Dejar una opinión